|
|
צפיפות = צפיפות מסה - מבטא את מסה ליחידת נפח. נוסחא אמפירית - ביטוי תרכובת פשוט בעל יחס מינימלי של אטומים בתרכובת ומבטא יחס אטומים בתרכובת. נוסחא מבנה - ביטוי שמתאר את מבנה המולקולה הסדר של האטומים וחיבורם במולקולה. תגובת שריפה מלאה - כאשר פחמימן (תרכובת המרוכבת מאטומי מימן ופחמן) מגיב עם o2 נותן לנו H2O וCO2 בתוצרים. נדרש לאזן את התגובה בהתאמה לפחמימן. איזון משוואות כימיות - יש לאזן משוואה כימית כך שמספר אטומים בצד המגיבים שווה למספר אטומים בצד התוצרים באמצעות שינוי מקדמים סטויכומטרים למולקולות. המקדם הסטויכומטרי לפני כל מולקולה מבטא עבורינו יחס מולים, מולקולות ונפח גזים. ולכן חשוב כדי שהכול ילך כשורה אז לפני כל פתרון שאלה נדרש לאזן את המשוואה ואז להתקדם לפתרון. מגיב מגביל - זה הוא מגיב שיש ממנו את הכמות הכי קטנה מבין כל המגיבים ולכן הוא יגיב במלואו עד תומו, ושאר המגיבים יישארו בעודף כי המגיב שאיתו הם מגיבים נגמר והם לא יכולים להמשיך להגיב. ניצולת - בתגובה כימית אנחנו יכולים להיעזר באמצעות יחס סטויכומטרי שיכול להגיד לנו בין היתר על יחסי המוליים בין המולקולות בתגובה. אנחנו יכולים להגיד כמה מולים יש למולקולה אחת באמצעות שימוש ביחסי מולים אם אנחנו יודעים מול של מולקולה אחרת בתגובה - זו ניצולת תאורתית זו התאוריה שלנו על סמך שימוש ביחסים סטויכומטרים. לעתים יש מצבים שבפועל מתקבל מול או גרם אחר ממה שחשבנו מהתאוריה ולכן זה נקרא ניצולת בפועל - כמה בפועל קיבלנו מהחומר באופן מעשי. נוסחא לניצולת הוא בפועל ניצולת חלקי הניצולת תאורתית כפול 100 נותן לנו את אחוז הניצולת. (בגרמים) תרגיל: שורפים 350 גרם מהפחמימן C7H16 עם 35 גרם חמצן. ג. כמה מולקולות CO2 יתקבלו בתגובה זו? פתרון מלא: 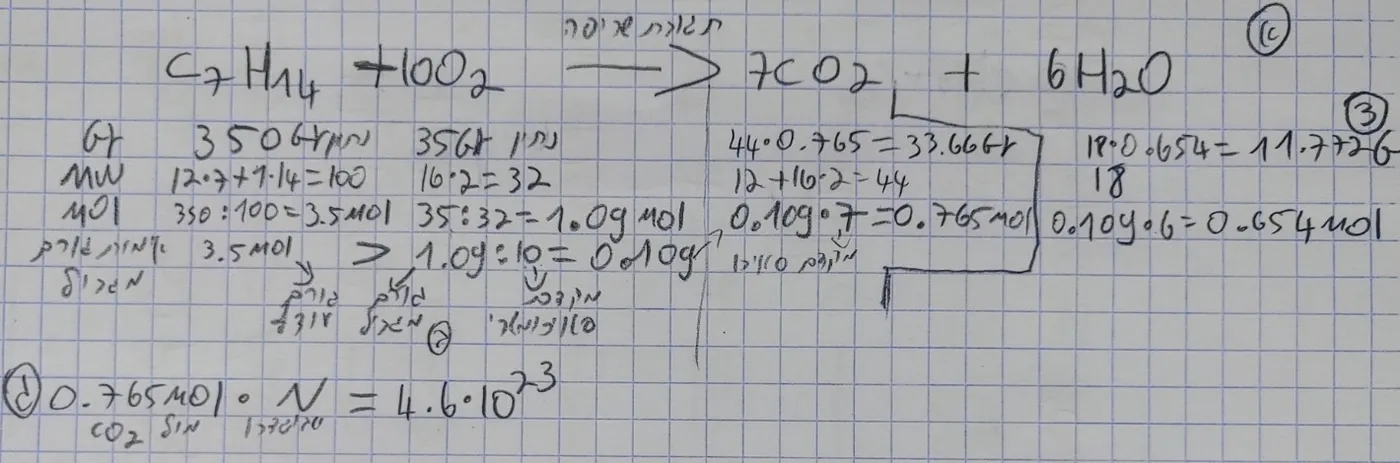 ------------------------------------------------------------------------------------------------------------------------ גזים אידיאלים מומס הוא חומר שמומס בתוך ממס הממיס את המומס. נוסחאת הגזים האידיאליים היא: PV=nRT V - נפח n - מול R - קבוע T - טמפרטוריה בקלווין (K). T(K)=T(C)+273.15 כלל: בתנאי לחץ וטמפרטורה שווים נפחים שווים של גזים מכילים מספר של מולקולות שווה ללא תלות בסוג הגז. לחץ גז מסוים חלקי לחץ הכללי = מולים של גז מסוים חלקי מולים הכללים. מדובר על יחס שנשמר. תמיסה - תערובת של חומרים כאשר אחד מתקפד כממס והאחר מתפקד כמומס בו. מסיסות - תכונה התקפה למומס כאשר הכמות המרבית שלה מתמוססת במומס. תמיסה רוויה - תמיסה המכילה את הכמות המרבית של המומס בממס. תמיסה רווית יתר - תמיסה המכילה יותר מומס מהכמות הדרושה כדי להגיע לתמיסה רוויה והעודף שוקע כך שיש לנו תמיסה רוויה עם עודף שוקע. מולריות (מול לליטר) - מול מומס חלקי ליטר התמיסה כולה נותן לנו מולריות. יש תלות בטמפרטורה כי הנפח תלוי בטמפרטורה ועלול להשתנות. מולליות - מספר מולים המומס חלקי מסה בק"ג של הממס. |
||||
\
My Company © 2025 All Rights Reserved