|
|
אטום ומודל מבנה האטום אטום - הוא "אבני הבניין" הבסיס לכל החומרים. כיום קיימים כ-100 אטומים שונים. ממספר של אטומים קטן ניתן ליצור מספר עצום של צירופים שונים. קשר כימי זה בין מספר אטומים נקרא "מולקולה". מודל מבנה האטום: 1. לאטום יש גרעין. 2. לאטום יש מעטפת העוטפת את הגרעין מצידו החיצוני. 3. לאטום יש פרוטונים, אלקטרונים ונאוטרונים: אלקטרוןאלקטרון הוא חלקיק במבנה בסיסי של האטום. מיקום: האלקטרונים מקיפים את גרעין האטום. מטען חשמלי: מטענו החשמלי של האלקטרון הוא שלילי (-). סימן באטום: באות e. *האלקטרונים נמצאים בתנועה מתמדת מסביב לגרעין במהירות עצומה מגיעה ל- 1,080,000 קמ"ש! פרוטוןפרוטון הוא חלקיקי במבנה בסיסי של האטום. מיקום: הפרוטון הוא נוכח בגרעין האטום. מטען חשמלי: הפרוטון בעל מטען חשמלי חיובי (+) סימן באטום: באות P. נאוטרוןנאוטרון הוא חלקיק במבה בסיסי של האטום. מיקום: הנאוטרון נמצא בגרעין האטום. מטען חשמלי: לנאוטרון אין מטען חשמלי (0) או (N) סימן באטום: באות n. בטבלה מסכמת:
תמונת מודל האטום: 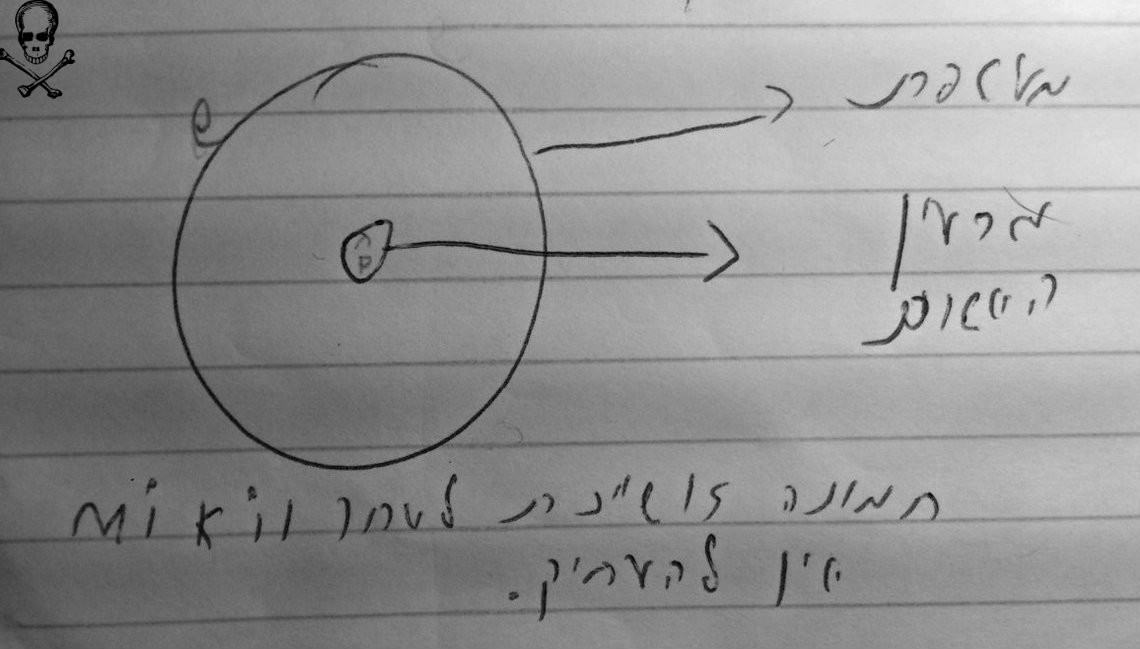 כוחות דחייה וכוחות משיכה באטום: ממש כמו בסוללה או מגנט שאנחנו מכירים פלוס נמשך למינוס, אבל פלוס לפלוס זה לא מסתדר. אז איך זה בא לידי ביטוי אצלנו באטום? ממש דומה: כוחות דחייהבין חלקיקים בעלי אותו מטען פועלים כוחות דחייה: אלקטרון ואלקטון = כוחות דחייה. פרוטון ופרוטון = כוחות דחייה. כוחות משיכהבין חלקיקים בעלי מטענים מנוגדים שונים פועלים כוחות משיכה: פרוטון ואלקטרון = משיכה. אלקטרון ופרוטון = משיכה.
כאשר אנו לא יכולים להשלים את הרמה האחרונה ל-8 כי אין עוד אלקטרונים באטום בכדי להשלים ל-8 אנו נבצע תהליך הנקרא "קשר קוולנטי". קשר קוולנטי - קשר קלוונטי הוא שיתוף אלקטרונים בין אטומי אל-מתכת. יש 3 סוגי קשרים קוולנטים: קשר קוולנטי יחידקשר זה הוא שיתוף של זוג אחד של אלקטרונים ברמה חיצונית של אטומים המשתתפים בקשר. קשר קוולנטי כפולקשר זה הוא שיתוף של 2 זוגות של אלקטרונים ברמה החיצונית של אטומים המשתתפים בקשר. קשר קוולנטי משולשקשר זה הוא שיתוף של 3 זוגות של אלקטרונים ברמה החיצונית של אטומים המשתתפים בקשר.
דוגמה: ברמה השנייה של האטום כלור יהיה 8 אלקטרונים. עד פה ניצלנו 10 אלקטרונים, נשאר לנו עוד 7 ולכן נפתח רמה נוספת, רמה שלישית. ברמה השלישית של האטום כלור יהיה 7 אלקטרונים, על פי כלל האוקטט אנו חייבים לסגור ל-8 אלקטרונים, לכן פה יתבצע קשר קלוונטי יחיד עם אטום אחר. וזאת ניתן לראות על פי האיור שלפנכם:

דוגמאות נוספות עם עוד אטומים:

יונים וקשרים יונים
אטום יוני - הוא מצב שבו אלקטרון מתנתק מאטום או נכנס לאטום מתקבל מספר לא שיווני של פרוטונים ואלקטרונים.
האטום מתחיל בכך שיש לו מספר שיווני של אלקטרונים לבין הפרוטונים ולכן האטום הוא נטרלי. יון תמיד יבוטא עם מטען חיובי\שלילי לידו בסימון המספר.
יון חיובי (קטיון) - אטום שאיבד אלקטרונים ויש לו יותר פרוטונים. יון שלילי (אניון) - אטום שקיבל אלקטרונים ויש לו יותר אלקטרונים מפרוטונים.
הסרת אלקטרונים באטום הוא כמות האלקטרונים שהוסרו בסימון של פלוס (+) באטום. הוספת אלקטרונים באטום הוא כמות האלקטרונים שנוספו בסימות של מינוס(-) באטום.
דוגמה: לדוגמה מה יקרה אם נוציא אלקטרון אחד לאטום? יהיו מטענים חיוביים (פרוטונים ) = למטענים השלילים (אלקטרונים) פחות 1. הכוונה שיש מטען שלילי פחות אחד מהמטען החיובי שבאטום. מצב זה כבר לא שיווני ולכן האטום לא נטרלי. בכמה? בדוגמה שהצגנו זה ב-1 ולכן הוא יהיה 1+. לדוגמה אם נוסיף 2 אלקטרונים לאטום? יהיו מטענים חיוביים = למטענים השלילים ועוד 2. הכוונה שיש מטען שלילי 2 יותר מהמטען החיובי שבאטום מצב זה גם לא שיווני ולא נטרלי. בכמה? בדוגמה שהצגנו זה ב-2 ולכן הוא יהיה 2-. לדוגמה אם נתבונן בטבלה המחזורית ונראה את אטום Na, יש לו רצון לאבד אלקטרון אחד כדי שיהיו לו 8 אלקטרונים ברמה האחרונה שלו ולהיות כמספר האלקטרונים כמו גז האציל Ne - אז Na יהיה +1 יון. 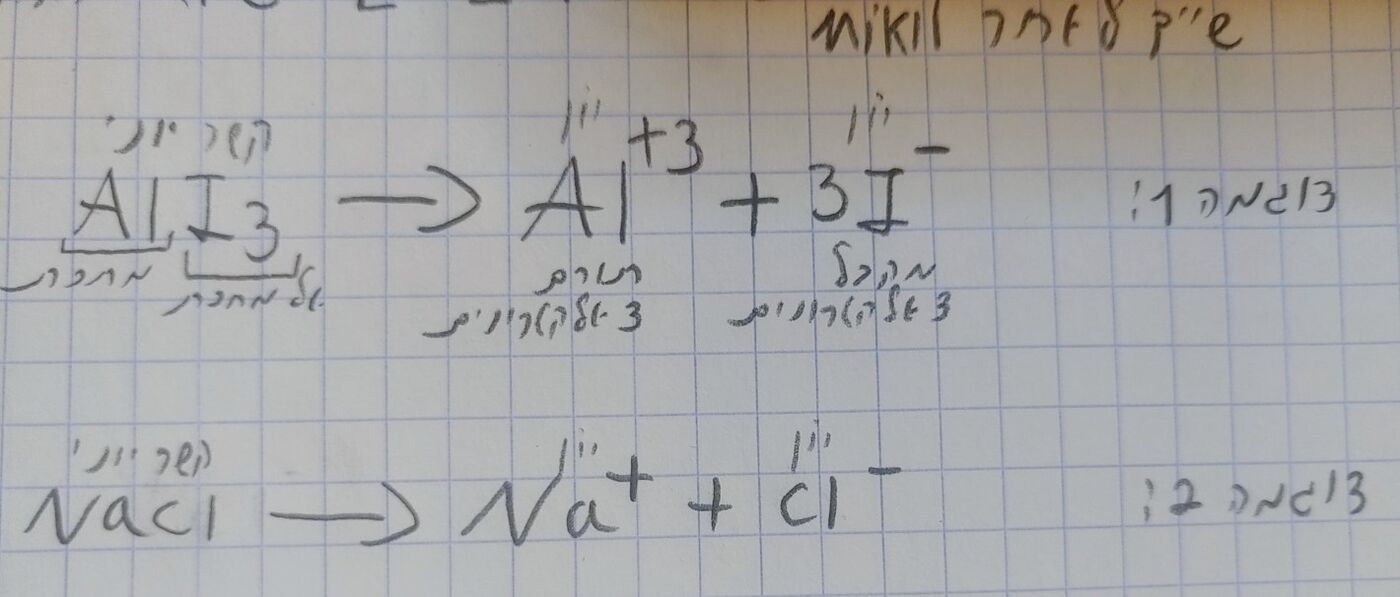
|
||||||||||||||||||||
\
My Company © 2025 All Rights Reserved